本文通过简要介绍常见的热能转换装置的工作过程,建立工质、热力系统、热力状态、状态参数、可逆过程、循环等概念,使我们能正确理解这些基本概念的定义和意义。
常见热能转换装置的工作过程:1、柴油机工作过程
柴油机是活塞式内燃机的一种,它的基本结构由固定部件、运动部件、配气系统、燃油系统、润滑系统、冷却系统、操纵系统组成,图1是四冲程柴油机工作原理示意图。
柴油以雾状喷入气缸,在气缸中与高温高压的空气混合并燃烧,燃烧后的高温高压燃气推动活塞下行并带动曲轴转动。燃料的化学能通过燃烧转化为热能,又通过曲柄连杆机构转化为输出的机械能,通过进、排气过程完成新鲜空气与废气的置换。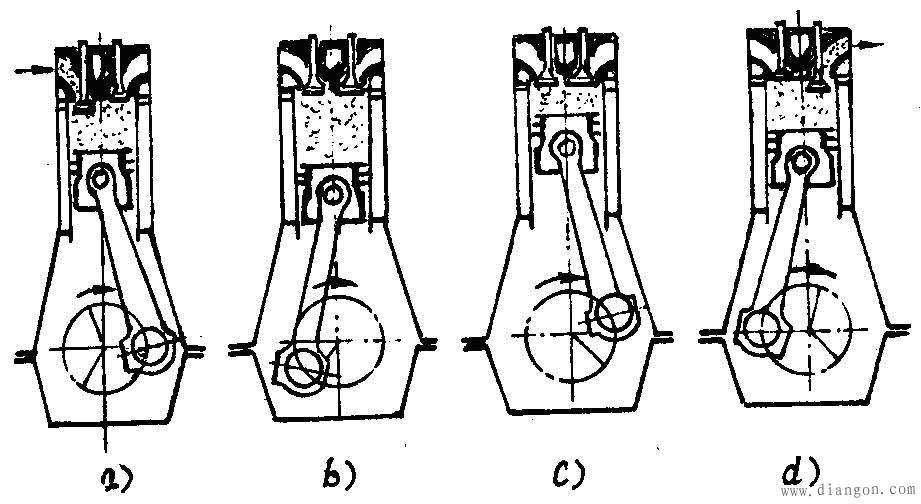
图1四冲程柴油机工作原理示意图
1)燃气轮机装置工作过程
简单的燃气轮机装置包括压气机、燃气轮机、燃油泵和燃烧室。图2是燃气轮机装置的示意图。油泵和压气机向燃烧室供给增压后的燃油和空气,它们在其中混合并燃烧,释放出热能,燃烧后的高温燃气在叶轮前的喷管中膨胀,把热能转换成动能,高温燃气转变成高速气流,高速气流冲击叶轮叶片,并使叶轮轮轴转动,向外输出机械能,作功后的废气由排气口排向大气并在大气中放热。
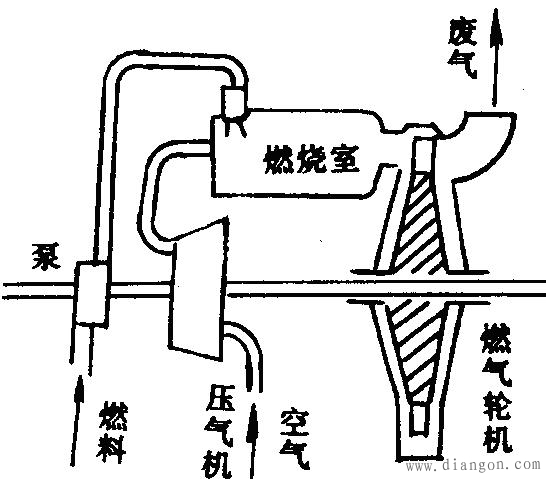
图2燃气轮机装置示意图
2)、蒸汽动力装置工作过程
蒸汽动力装置由锅炉、蒸汽轮机、冷凝器、水泵所组成,燃料在锅炉的炉膛内燃烧,将燃料的化学能转变成烟气的热能,经炉膛沸水管壁传热给管内的水,水受热后变成蒸汽储藏在汽包内,包内的蒸汽又通过过热器进一步加热后,输送到汽轮机,蒸汽进入汽轮机后,先在汽轮机进口处的喷管中膨胀,转变成高速气流,高速气流冲击汽轮机叶片,并使汽轮机轮轴转动,向外输出机械能。作功后的乏汽排入冷凝器,在冷凝器中放热并冷凝成水,水再由水泵送入锅炉,经加热后又变成蒸汽。如此循环往复,蒸汽动力装置就不断地将热能转换成机械能并传输给外界。
3)、蒸汽压缩制冷装置的工作过程
产生并保持比环境温度低的温度需要制冷装置。在船上及生活等领域普遍采用蒸汽压缩制冷装置。蒸汽压缩制冷装置的基本设备由压缩机、冷凝器、热力膨胀阀、蒸发器(冷库)所组成,图4为它的示意图。
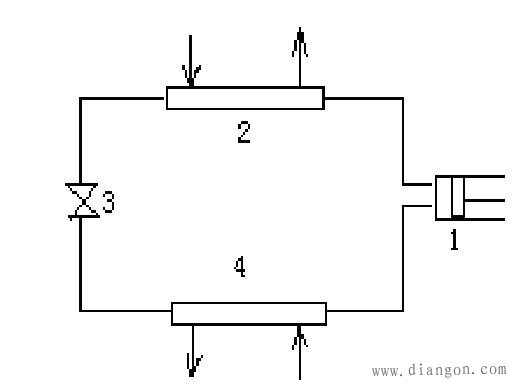
图4 蒸汽压缩制冷装置工作示意图
从对上述四个热能转换装置工作过程的介绍可以看出,柴油机、燃气动力装置、蒸汽动力装置虽然它们的工作原理、设备各不相同,但都是将热能转变成机械能的装置,这也是一切热动力机能量转换的共同方式;而蒸汽压缩制冷装置则是用消耗机械能的方式将低温制冷剂升高温度,使从冷库中取出的低温热量和消耗的压缩功一起放给环境。消耗一定的能量才能使低温热量传向高温环境,这也是一切制冷装置的工作原理。
2、工质
从上述热力设备的工作过程中我们知道,在热能和机械能的相互转换中必须要有一个工作物质,例如柴油机的工作物质为空气和燃气,蒸汽动力装置的工质为水和水蒸汽,蒸汽压缩制冷装置的工作物质为制冷剂。在热力转换过程中由这个工作物质来吸收热量膨胀并对外做功,或者由这个工作物质把从冷库吸收的热量放给环境,没有这个工作物质,就不可能实现热能和机械能之间的转换。我们把这个工作物质称为工质,即实现热能和机械能相互转换的媒介物称为工质。
作为工质的物质必须具有良好的膨胀性、压缩性和流动性。所以,热动力装置所用的工质都为气态物质,如空气、燃气和蒸汽。
1)热力学系统
从上述热能转换装置的工作过程我们知道,任何一种能量转换装置都是由几个相互作用的实现能量转换或传递的热力设备所组成的。例如蒸汽动力装置是由锅炉、蒸汽轮机、冷凝器、水泵所组成。为了进行热力学分析,首先我们要在相互作用的各种热力设备中划分一个(或几个)热力设备作为研究对象,这种被划分出来的研究对象称为热力学系统,简称系统。系统之外的其它热力设备统称为外界。系统与外界的分接口称为边界。边界可以是真实的,也可以是设想的。例如取压缩空气瓶内的空气为系统,则瓶的内壁面就是真实的边界;而当取废气涡轮内的空气作为系统时,则进出口处的边界是设想的。
热力学系统与外界一般有三种相互作用:系统与外界的物质交换,热的交换和功的交换。按照系统与外界相互作用的特点,在热力学中往往把系统分为下述几类。
闭口(封闭)系统:系统与外界没有物质的交换。例如把柴油机气缸中正进行膨胀的燃气选作系统,尽管燃气会从气缸与活塞的缝隙间漏泄一点,但泄漏量极小,可以足够精确地看作系统与外界没有物质交换,这就是封闭系统,如图5所示。封闭系统是由闭合表面包围的质量恒定的物质集合。封闭系统与外界可以有热和功的交换,也可以没有。
开口系统:系统与外界有物质的交换。例如把废气涡轮选作系统,它有工质的流入与流出,这就是开口系统,如图6所示。开口系统与外界可以有热和功的交换,也可以没有。
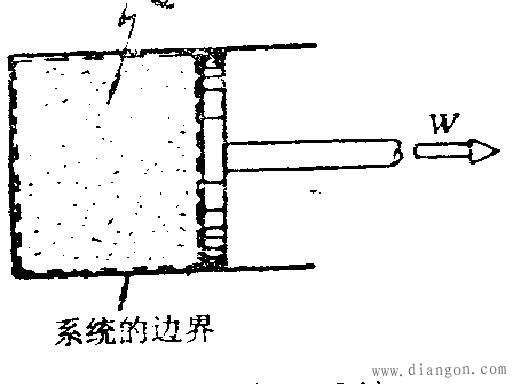
图5封闭系统
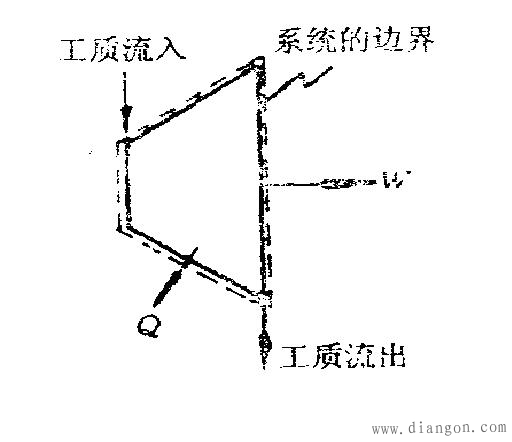
图6 开口系统
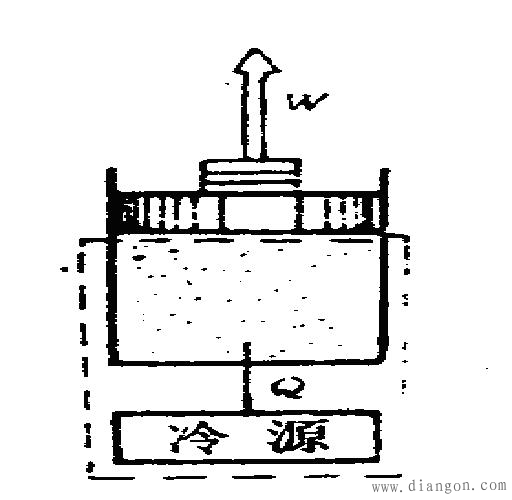
图7 绝热系统
绝热系统:系统与外界没有热量的交换。如图7所示的燃气膨胀时有热量传给冷却水,如取燃气和冷却水(通常称为冷源)为系统,则包括燃气和冷却水的系统与外界没有热交换,因而该系统为绝热系统。
孤立系统:系统与外界没有物质交换,也没有热和功的交换。如果把所有发生相互作用的各种热力设备作为一个整体,并把这个整体选定为所研究的系统,虽然这个系统内部的各部分可以有物质交换、热和功的交换,但这个系统作为整体与外界没有任何相互作用,那么这个系统就是孤立系统。
与系统发生作用的外界也可分为以下几种:
热源:热力学中将与系统只发生热的相互作用的外界,称为“热源”。温度高的热源称为高温热源,温度低的热源称为低温热源,并且认为热源的容量足够大,它吸入和放出有限热量时温度保持不变。
功源:热力学中将与系统只发生功的相互作用的外界定义为“功源”。功源与封闭系统交换的功是直接通过系统中工质膨胀或压缩引起的容积改变实现的,称为“容积功”;功源与开口系统交换的功通过转轴传递,称为“轴功”。习惯上,系统对外界(功源)作功为正值,外界(功源)对系统作功为负值。
质源:热力学中将与系统进行物质交换的外界定义为“质源”
2)热力系统的状态参数
从上面的讨论可以知道,当系统处于平衡状态时,可以用确定的唯一的一组状态参数值来描述它。在工程热力学里,常用的状态参数有六个,即压力、温度、容积、内能、焓和熵。在这六个状态参数中,只需知道其中任意两个独立的状态参数就可以决定一个状态,所以工质的状态也可以用参数坐标图表示。
工程上把可直接观察和测量的状态参数称为基本状态参数,它们是压力、温度和比容。
在工程热力学中,把工质指向系统表面(真实的容器壁或假想的分接口)单位面积上的垂直作用力,称为“压力”(即压强)。分子运动论把气体压力看作是气体分子撞击壁面的宏观表现,数值上等于单位容积内的分子数与分子的平均移动动能乘积的三分之二。
压力的定义式:![]()
上式中:P------工质指向表面的垂直作用力,单位为牛顿,用N表示;
f-------作用面积,单位为平方米,用m2表示。
压力的国际单位为N/m2,称为帕斯卡,简称“帕”,符号为Pa。
系统的真实压力称为绝对压力,绝对压力p是工质的状态参数。因为不管用什么测压仪表,如图8弹簧管压力表、图9U形管压力计,测得的是工质的绝对压力p与大气压力pb之间的相对值。因为大气压力随时随地都会发生变化,所以测量值不等于系统的真实压力值,不能真实地表示系统内工质所处的热力状态,所以这个相对值就不是工质的状态参数
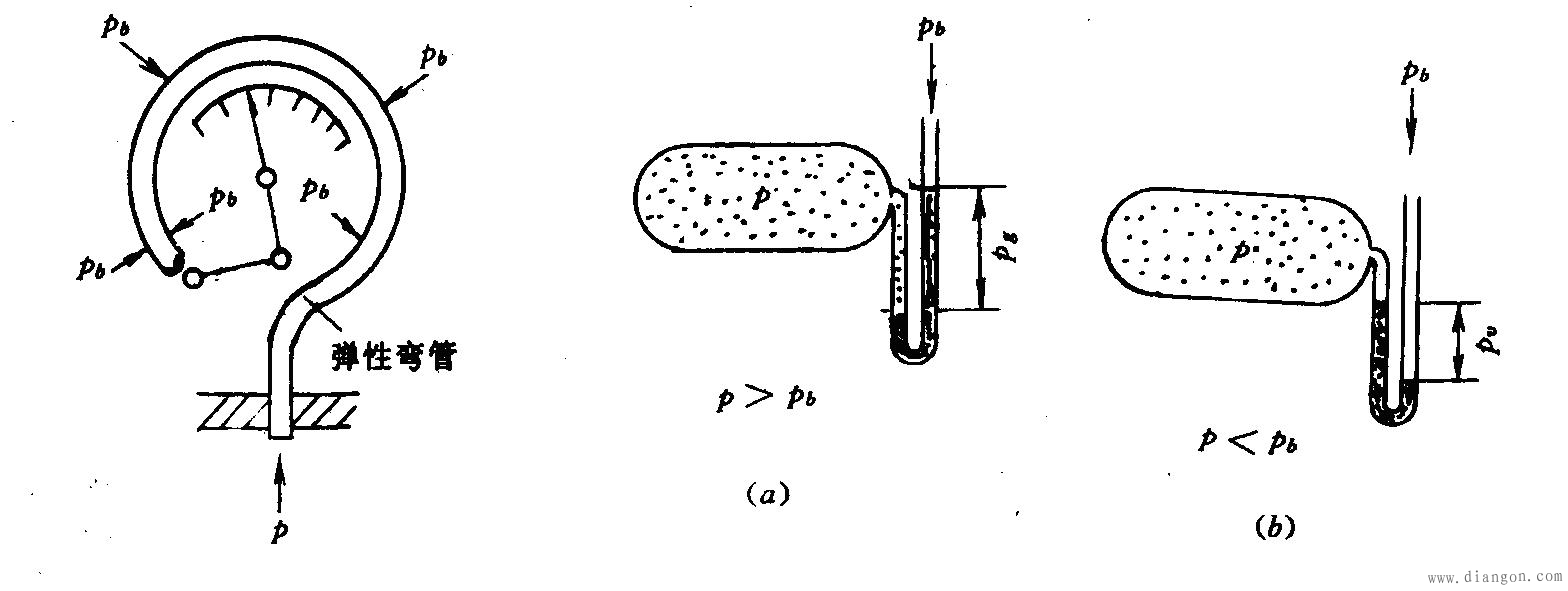
图8 弹簧管压力表 图9 U形管压力计
当绝对压力高于大气压力(p> pb)时,压力表(计)指示的数值称为表压力,用pg表示,如图9(a)所示。显然,这时系统绝对压力为: 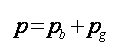
当绝对压力低于大气压力(p< pb)时,压力表(计)指示的读数称为真空度,用pv表示,如图9(b)所示。显然,这时系统的绝对压力为: ![]()
3)、温度
从热力学的角度来看,处于热平衡的各个系统,必定有某一宏观特性是彼此相同的,描述此宏观特性的物理量称为温度。
从宏观上来看,温度是表示工质冷热程度的量度,温度是判断工质能否从外界接受热量,或者对外传出热量的根据。
温度的数值表示方法称为温标,常用的温标有以下三种:
摄氏温标:即在标准大气压力下,纯水的冰点规定为0度,沸点为100度,在这两点之间均分为100等分,取其中的一份为摄氏1度,记作:1℃,摄氏温标用符号t℃表示。
华氏温标:即在标准大气压力下,纯水的冰点规定为32度,沸点为212度,在这两点之间均分为180等分,取其中的一份为华氏1度,记作:1oF,华氏温标用符号toF表示。
热力学温标:又称绝对温标,它是以摄氏零下273.15度作为绝对温标的零度,每度的间隔与摄氏温标相同,1度记作1K,开氏温标用符号TK表示。
大部分国家应用摄氏温标,英、美等国家采用华氏温标,工程热力学计算中常用绝对温标,因此必须掌握它们之间的换算。
根据上述三种温标的定义,如果已知摄氏温度为t℃,则相当于华氏温度为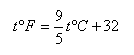
若已知华氏温度为toF,则相当于摄氏温度为 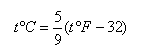
若已知摄氏温度为t℃,则绝对温度为 ![]()
4)、容积和比容
一定质量的工质所占有的空间称为工质的容积,用V表示,单位是m3。单位质量工质的容积称为比容,用符号v表示,单位为m3/kg。设质量为m kg的工质所占的容积为V m3,则其比容为:
v=V/m m3/kg。
容积和比容均为工质的热力状态参数。
5)、内能和比内能
物质内部具有各种能量,如由原子结合成分子的化学能、原子内部的原子能以及分子不规则运动的热能。工程热力学研究的是热能与机械能之间的相互转换,因此把工质具有的热能称为内能。用U表示,单位是KJ。单位质量工质的内能称为比内能,用u表示,单位为KJ/kg。可见 u=U/ m
6)、焓和比焓
因为工质流经开口系统时其比内能u和压力与比容的乘积pv总是同时出现,所以在热力学中把这两者之和称这比焓,用h表示,单位是KJ/kg。即 ![]()
对于mkg处于平衡状态的工质,则有 ![]()
式中的H称为mkg工质的焓,单位为KJ。
因为U、u、p和v均为工质的状态参数,因此焓和比焓也为工质的热力状态参数。
7)、熵和比熵
在一个微元过程中,mkg工质从热源吸收的微元热量dQ除以工质吸热时的绝对温度T所得的商,定义为工质在绝对温度T时熵S的增量dS, ![]() 即 将上式两边除以m,得
即 将上式两边除以m,得![]()
熵S的单位为KJ/k,s为工质的比熵,单位是KJ/kg.k。熵和比熵均为工质的热力状态参数。
由以上两式可知,dq>0,则ds>0,即系统从热源吸热,工质比熵增加;反之,dq<0,则ds<0,即系统向热源放热,工质比熵减少;若dq=0,则ds=0,即系统与热源绝热,工质比熵不变。因此我们可以根据工质比熵的变化来判断系统与外界热传递的方向。
对内能U或比内能u、焓H或比焓h、熵S或比熵s,在热力学的计算中只用到它们的变化量,因此它们为零值的基准态可以人为地选定。
